
Ansiedad Materna Prenatal, Desarrollo Psicológico Infantil y Reactividad del Eje HPA en Bebés de 2 a 3 Meses de Edad
[Antenatal maternal anxiety, infant psychological development, and HPA axis reactivity in 2-3 month old infants]
Fátima Prietoa, José A. Portellanob y José A. Martínez-Orgadoc
aUniversidad Internacional de la Rioja, España; bUniversidad Complutense de Madrid, España; cHospital Clínico San Carlos, Madrid, España
https://doi.org/10.5093/clysa2019a5
Recibido a 29 de Octubre de 2018, Aceptado a 8 de Enero de 2019
Resumen
Los bebés expuestos a altos niveles de ansiedad materna durante la etapa prenatal pueden desarrollar un eje HPA (hipotálamo pituitario adrenal) más reactivo, lo que supone vulnerabilidad a padecer psicopatologías. En este estudio prospectivo investigamos las relaciones entre la ansiedad prenatal maternal, el desarrollo psicológico infantil y la reactividad del eje HPA en bebés de 2 a 3 meses. Recogimos datos de cuarenta y seis díadas de madres y bebés. El análisis principal no reveló relaciones significativas entre las tres variables estudiadas, pero la variabilidad apuntó a que la ansiedad materna prenatal podría asociarse a efectos diferenciales en la reactividad del eje HPA en función del desarrollo psicológico infantil. Además, los resultados indicaron que las madres con ansiedad prenatal presentaban otros síntomas psicopatológicos, como sensibilidad interpersonal (p < .001) y obsesión-compulsión (p < .001). Esto es significativo para futuras investigaciones y a nivel clínico para promover intervenciones psicológicas durante la gestación.
Abstract
Babies exposed to high levels of maternal anxiety during the prenatal period may develop a more reactive HPA (hypothalamic-pituitary-adrenal) axis, which poses a vulnerability to psychopathology. In this prospective study, we investigated the relationships between antenatal maternal anxiety, infant psychological developmen,t and HPA axis reactivity in 2 to 3-month-old babies. We use data from forty-six mother-child dyads. The main analysis did not reveal significant relationships between the variables studied, but the variability pointed out that antenatal maternal anxiety could be associated with differential effects on the reactivity of the HPA axis according to the child’s psychological development. In addition, the results indicated that mothers with prenatal anxiety presented other psychopathological symptoms, such as interpersonal sensitivity (p < .001) and obsession-compulsion (p < .001). This is significant for future research and - at a clinical level - to promote psychological interventions during pregnancy.
Palabras clave
Embarazo, Ansiedad prenatal, Eje HPA, Programación fetal, Desarrollo infantil
Keywords
Pregnancy, Antenatal anxiety, HPA axis, Fetal programming, Infant development
Para citar este artículo: Prieto, F., Portellano, J. A. y Martínez-Orgado, J. A. (2019). Ansiedad materna prenatal, desarrollo psicológico infantil y reactividad del eje HPA en bebés de 2 a 3 meses de edad. Clínica y Salud, 30, 21-31. https://doi.org/10.5093/clysa2019a5
Correspondencia: fatima.prieto@unir.net (F. Prieto).
Introducción Lo que ocurra durante las 40 semanas de gestación va a condicionar en gran medida el desarrollo infantil. Diversas investigaciones han revelado que la salud psicológica materna influye en el desarrollo fetal y que esto tiene repercusiones a lo largo del desarrollo del niño al asociarse con diferentes psicopatologías de inicio en la infancia, como los trastornos de conducta y los trastornos de aprendizaje (Glover, 2011; Li, Olsen, Vestergaard y Obel, 2010). En la última década se ha aportado evidencia del origen fetal de la sensibilidad al estrés en el marco de la teoría de la programación fetal (Entringer, Kumsta, Hellhammer, Wadhwa y Wust, 2009; Grant et al., 2009; Gutteling, De Weerth y Buitelaar, 2005; O’Connor et al., 2005). Según esta teoría, el desarrollo del feto se verá alterado por los cambios ambientales en el útero materno, los cuales tendrán efectos posteriormente en la infancia e incluso en la etapa adulta (Glover, O’Connor y O’Donnell, 2010). Desde el ámbito de la psicobiología animal, numerosos estudios han demostrado que la ansiedad prenatal puede tener efectos en la programación del neurodesarrollo y del eje hipotálamo-pituitario-adrenal (HPA) (Green et al., 2011; Schroeder, Sultany y Weller, 2013; Weinstock, 2001, 2005, 2008; Wilson, Vazdarjanova y Terry, 2013). En el ámbito de la psicobiología humana las evidencias no son tan claras: a pesar de que la investigación al respecto en los últimos años ha sido creciente, se hace necesario generar más estudios que investiguen la relación entre la ansiedad materna y la programación fetal del eje HPA para confirmar los hallazgos que parecen evidenciarse desde la psicobiología animal. Las pocas investigaciones con humanos que han relacionado la ansiedad materna prenatal con la reactividad del eje HPA infantil no aportan conclusiones esclarecedoras (Tabla 1). Algunas evidencias han encontrado una asociación positiva entre la ansiedad materna y la reactividad del eje HPA del bebé, otras pruebas han encontrado una asociación negativa y finalmente otras no han encontrado asociación entre ambas variables. Por una parte, Grant et al. (2009) estudiaron en niños de 7 meses las variaciones de cortisol en función de la ansiedad prenatal y de la sensibilidad maternal. En concreto, estos autores investigaron la reactividad del eje HPA de los bebés mediante el procedimiento Still-Face, un paradigma que utiliza la indiferencia emocional de la madre como estresor. Usando este procedimiento Grant et al. (2009) concluyeron que la ansiedad prenatal y la baja sensibilidad maternal producen un aumento de los niveles de cortisol de manera independiente y sumativa. Por otra parte, Brennan et al. (2008) estudiaron el efecto concomitante de la ansiedad y la depresión prenatal en la reactividad del eje HPA infantil a los 6 meses de edad, hallando como resultado un aumento en el nivel de cortisol posestresor. Estos resultados apuntan al efecto programador de la ansiedad y depresión prenatal sobre el eje HPA, pero adolecen de no diferenciar claramente a nivel metodológico el efecto de la depresión perinatal y posnatal. En otro estudio longitudinal, el equipo de Tollenaar (Tollenaar, Beijers, Jansen, Riksen-Walraven y de Weerth, 2011) estudió la reactividad del eje HPA de los niños de madres estresadas prenatalmente en diferente edades y con diferentes procedimientos estresantes. Los autores concluyeron que el efecto de la ansiedad prenatal sobre la reactividad del eje HPA depende de la naturaleza del estresor y de la edad del niño. La ansiedad prenatal predijo un aumento de cortisol en la rutina del baño a las 5 semanas mientras que se observó una reducción del nivel de cortisol en la vacunación a los 2 meses y en la separación maternal al año. El estresor del procedimiento Still-Face no generó diferencias en el nivel de cortisol a los 5 meses de edad. Tabla 1 Estudios que relacionan la ansiedad materna prenatal y la reactividad del eje HPA (R-HPA)  De la misma forma, encontramos datos contradictorios respecto a la relación entre la ansiedad materna prenatal y el desarrollo psicológico infantil durante los primeros años de vida. Mediante la Escala de Evaluación del Desarrollo Infantil de Bayley (Bayley, 2006) se ha comprobado que la ansiedad materna durante la mitad de la gestación predice un rendimiento cognitivo y motor inferior a la media entre los 3 y los 8 meses de edad, aunque a los 8 meses este efecto es más significativo (Huizink, Robles de Medina, Mulder, Visser y Buitelaar, 2003). Utilizando la misma escala también se ha comprobado un retraso cognitivo en niños de 2 años cuyas madres habían padecido estrés durante el embarazo a causa de un desastre natural (King y Laplante, 2005). Bergman y su grupo (Bergman, Sarkar, O’Connor, Modi y Glover, 2007) también ofrecen datos en este sentido en niños de 14 y 19 meses. No obstante, otros autores no encontraron diferencias en el desarrollo motor y cognitivo en bebés de 7 meses de edad en función de la ansiedad prenatal (Van den Bergh, 1990). Para añadir más controversia a estos datos, DiPietro y su equipo encontraron una relación positiva entre la ansiedad prenatal y el desarrollo motor de los niños a la edad de 2 años, es decir, los niños con madres ansiosas, estresadas o deprimidas durante el embarazo demostraron mayor rendimiento en la BSID (DiPietro, Novak, Costigan, Atella y Reusing, 2006). Ante este panorama de resultados contradictorios es esencial aportar nuevos datos sobre las relaciones entre la ansiedad materna prenatal y la reactividad del eje HPA y entre la ansiedad materna prenatal y el desarrollo psicológico infantil. Es necesario abordar con más profundidad las relaciones entre estas variables y además aportar una visión novedosa para esclarecer cómo se interrelacionan la ansiedad materna prenatal, la reactividad del HPA y el desarrollo psicológico infantil entre sí. El objetivo principal de este estudio fue investigar la relación que tienen la ansiedad prenatal, el desarrollo psicológico y la reactividad del eje HPA en bebés de entre 2 y 3 meses. Nuestra hipótesis se centró en comprobar que la respuesta de cortisol de los bebés difería en función de la ansiedad materna prenatal y que además el desarrollo psicológico infantil moderaba la relación entre la ansiedad prenatal materna y las respuestas de cortisol infantiles. MétodoParticipantes y Reclutamiento Para la realización de este estudio propectivo reclutamos a 141 mujeres en el tercer trimestre de gestación en el Hospital Puerta de Hierro de Majadahonda. Todas las gestantes eran castellano-parlantes, presentaban embarazo único entre la semana 36 y 41 y no presentaban ninguna patología médica (e.g., hiper o hipotiroidismo) o psicológica (e.g., depresión o esquizofrenia) que les impidiese participar. Se indica el procedimiento de reclutamiento de la muestra en la Figura 1. Figura 1 Diagrama de flujo del procedimiento de muestreo utilizado en la presente investigación. 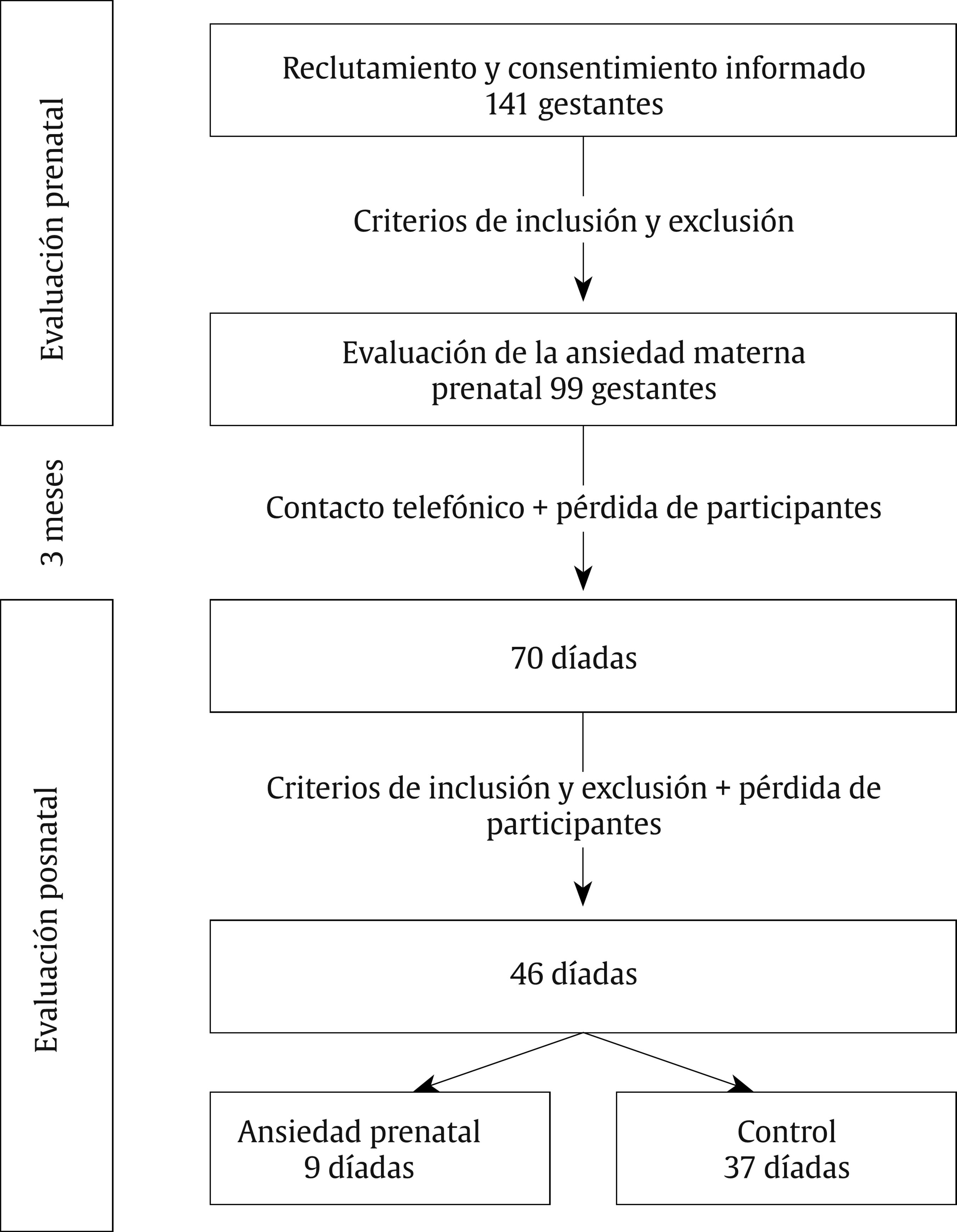 Procedimiento Se administró una batería de pruebas psicológicas, compuesta por una medida de ansiedad general, una medida de ansiedad específica prenatal y una medida de síntomas psicopatológicos, a las gestantes durante las sesiones de monitorización fetal. En esta primera sesión también se recogieron datos sobre variables sociodemográficas, preconcepcionales y prenatales de interés para la investigación. Pasados tres meses se citó de nuevo a las madres en el hospital para una segunda sesión de evaluación, en la que se recogieron datos sobre aspectos perinatales, neonatales y síntomas maternos de ansiedad y otros tratornos psicológicos posnatales. En esta segunda sesión las díadas fueron expuestas al procedimiento estresante Still-Face y se realizó la evaluación del desarrollo psicológico de los bebés. Procedimiento Still-Face. El paradigma Still-Face es un procedimiento experimental para evaluar o suscitar en los bebés una respuesta emocional ante un estímulo social aversivo como es la cara inexpresiva materna. En nuestra investigación la estructura del procedimiento Still-Face consistió en las tres fases originalmente propuestas por Tronick, Als, Adamson, Wise y Brazelton (1978), pero variando la duración de las mismas según la propuesta de Bertin y Striano (2006) para adaptar el procedimiento a la edad de los bebés (entre 2 y 3 meses). Según esta propuesta el paradigma mantuvo una duración total de 3 minutos, por lo que la duración de cada fase fue de 1 minuto en lugar de los 3 minutos propuestos por Tronick, Als, Adamson, Wise y Brazelton (1978). Se instruyó a las madres explicando las tres fases del procedimiento: en la primera podrían interaccionar con su bebé como lo hacían normalmente (hablando, tocando, besando, cantando, etc.), en la segunda debían permanecer inmóviles y con la cara inexpresiva (no mostrar alegría, ni enfado), y además no podían hablar, tocar o realizar cualquier contacto con el bebé, y en la tercera y última instruimos a las madres para que reanudaran la interacción con las mismas premisas que en la primera fase. Después, se preparó a los bebés en una hamaca infantil, con la madre colacada frente al niño. Durante las tres fases, se observaron las reacciones del bebé (operativizadas como sonrisa, evitación de la mirada y expresión negativa) apuntando su ocurrencia en la hoja de registro de observaciones. La mayoría de las investigaciones que han estudiado el efecto Still-Face concluyen que las conductas que los bebés exhiben en esta situación son principalmente la evitación de la mirada y la disminución de las sonrisas (Adamson y Frick, 2003; Bertin y Striano, 2006; Mesman, van IJzendoorn y Bakermans-Kranenburg, 2009; Muir y Lee, 2003). Recogida y procesamiento de la muestra de saliva. Para la recogida de las muestras de cortisol en saliva de los bebés se tomaron una serie de precauciones: cuando contactamos telefónicamente con cada una de las madres, les dimos instrucciones para que alimentaran a sus bebés como mínimo 30 minutos antes de la sesión para poder extraer las muestras de saliva. Se tomó esta precaución debido a que la presencia de sustancias en la boca de los bebés, como la leche materna, puede interferir en los resultados de la determinación de cortisol (Magnano, Gardner y Karmel, 1992). Una vez en la sesión de evaluación posnatal, inmediatamente antes de exponer a las díadas al procedimiento Still-Face se tomó la primera muestra de saliva a los bebés para medir el cortisol preestresor o línea base. Tras la aplicación del procedimiento se recogió la segunda muestra en saliva 20 minutos después para valorar el cortisol posestresor. Se eligió este período temporal porque se ha comprobado que el pico de la respuesta de cortisol en bebés surge entre los 20-25 minutos después del estresor (Ramsay y Lewis, 2003). Para la recogida de las muestras de saliva de los bebés se frotó un algodón dental bajo la lengua y los mofletes de los bebés durante 2-4 minutos. Para facilitar la salivación de los bebés no se utilizaron estimulantes (como introducir unas gotas de limón en la boca del bebé) con objeto de evitar la contaminación de las muestras. Estas se procesaron en el laboratorio a través de un inmunoensayo de electroquimioluminiscencia (ECLIA) de Roche® (el límite inferior de detección de cortisol fue 0.500 nmol/l). Medidas Evaluación prenatal State-Trait Anxiety Inventory (STAI). Para evaluar la ansiedad materna prenatal utilizamos el STAI (Spielberger, Gorsuch y Lushene, 1997). Este instrumento ha sido ampliamente utilizado en las investigaciones clínicas con muestras de gestantes y diversos investigadores han demostrado su idoneidad y sensibilidad para captar la ansiedad prenatal (Gunning et al., 2010; Hundley, Gurney, Graham y Rennie, 1998). Pregnancy Anxiety Scale (PAS). Para la obtención de la medida de ansiedad específica durante el embarazo utilizamos la PAS (Levin, 1991). Es un instrumento específico diseñado concretamente para la gestación, por lo que es más útil que los instrumentos que ofrecen un diagnóstico de ansiedad general. Según Levin (1991), la PAS muestra garantías psicométricas para su uso en la investigación sociológica en el ámbito de la salud materna e infantil, pero debido a que presenta inconsistencias para detectar los errores de medición es recomendable que los investigadores utilicen instrumentos específicos del embarazo junto con otras pruebas cuya fiabilidad esté contrastada, como es el caso del STAI. Symptom Checklist-90-Revised (SCL-90-R). Para controlar otros síntomas psicopatológicos se administró a las gestantes el SCL-90-R (Derogatis, 2002) en su versión española actualizada (González de Rivera, De las Cuevas, Rodríguez-Abuín y Rodríguez-Pulido, 2002). Debido a las garantías psicométricas que ofrece esta prueba, se ha utilizado como medida psicopatológica durante el período prenatal (Mamelle, Gerin, Measson, Munoz y Collet, 1987). Evaluación posnatal International Neuropsychiatric Interview (MINI). Para controlar la posible psicopatología posnatal en las gestantes se utilizó la versión española de la MINI (Ferrando, Bobes, Gibert, Soto y Soto, 2000). La MINI es una entrevista diagnóstica que explora de manera estructurada los principales trastornos psiquiátricos del eje I del DSM-IV-TR (First, Frances y Pincus, 2001) y la CIE-10 (Organización Mundial de la Salud, 2008). Esta entrevista presenta una adecuada fiabilidad y validez como instrumento de screening psicopatológico y ha sido utilizada ampliamente en el diagnósticos de mujeres en el período prenatal y posnatal (Adewuya, Ola, Dada y Fasoto, 2006; Berle, Aarre, Mykletun, Dahl y Holsten, 2003; Mchichi Alami, Kadri y Berrada, 2006; Smith et al., 2004; Su et al., 2007). Beck Anxiety Inventory (BAI). El BAI (Beck, Epstein, Brown y Steer, 1988) es un instrumento diseñado para evaluar ansiedad. En el ámbito prenatal y posnatal ha sido una herramienta de referencia para valorar la presencia de ansiedad maternal en relación a diversas circunstancias, como depresión posparto (Kim, Hur, Kim, Oh y Shin, 2008) o apego maternofetal (Schmidt y Argimon, 2009). Dado que es una herramienta ampliamente utilizada en la investigación prenatal y posnatal, utilizamos el BAI en el presente estudio para valorar la ansiedad posnatal a modo de control. Asimismo, tal y como aconsejan Osman, Kopper, Barrios, Osman y Wade (1997), usamos el BAI acompañado de la entrevista MINI para complementar la medida de ansiedad posnatal. Revised Brunet-Lézin: Scale of Psychomotor Development in Infancy (BL-R). El desarrollo psicológico infantil fue medido mediante la escala BL-R (Josse, 1997) aproxidamente a los 3 meses de edad de los bebés. Ofrece una puntuación en cuatro áreas de desarrollo: postural, coordinación visomanual, lenguaje y sociabilidad. Para cada área se puede hallar el cociente de desarrollo (QD) específico o parcial y además se puede calcular el cociente de desarrollo global (QD global) del niño en referencia a su grupo normativo según la edad. ResultadosFormación de los Grupos Las mujeres seleccionadas para el estudio fueron clasificadas como ansiosas o no ansiosas (controles) en función de su puntuación en el STAI. Utilizamos como punto de corte para la formación del grupo ansiedad una puntuación por encima del percentil 70 tanto en la escala estado (A/E) como en la escala rasgo (A/R). Tanto la A/E como A/R correlacionaron significativamente con el factor ansiedad ante el embarazo de la PAS (r = .30, p < .05 y r = .52, p < .001, respectivamente). No hubo correlación significativa entre las subescalas del STAI y los factores ansiedad ante el parto y ansiedad ante la hospitalización de la PAS. En los grupos control y ansiedad materna prenatal encontramos diferencias significativas en cuanto al factor ansiedad ante el embarazo (Z = -2.67, p < .05), pero no en la ansiedad durante el parto (t =-1.62, p = .113) ni en la ansiedad en la posterior hospitalización (Z = -1.77, p = .076). Se pueden observar las puntuaciones directas de cada grupo en la Tabla 2. Tabla 2 Medidas de ansiedad maternas 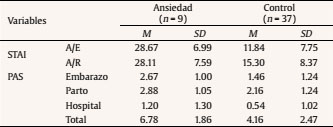 Análisis Descriptivo La media de edad de las gestantes fue de 32.93 años (rango de edad: 21-42). Respecto a las variables obstétricas, la media de semanas de gestación fue de 39.13 (SD = 1.39) y el tipo de embarazo predominante fue de bajo riesgo (80.43%). La mayoría de las gestantes estaba casada (73.91%), poseía nacionalidad europea (86.96%) y estudios superiores (69.57%) y se dedicaba a profesiones liberales (67.39%). Respecto al nivel socioeconómico, fue medio en el grupo control (54.05%) y alto en el grupo ansiedad materna prenatal (55.56%). En cuanto a las variables sociodemográficas de los bebés, el grupo total presentaba una edad entre los 60 y los 108 días (M = 73.78 días, SD = 11.55). La mayoría de los bebés fueron niños (58.70%) y nacieron en primer lugar (63.04%). Los grupos fueron homogéneos en todas las variables sociodemográficas, obstétricas y perinatales. Hubo una excepción en la variable prenatal deseo del embarazo (χ2 = 10.05, p < .05). Las características maternas e infantiles detalladas de la muestra se pueden observar en la Tabla 3 y la Tabla 4, respectivamente. Tabla 3 Características maternas por grupos 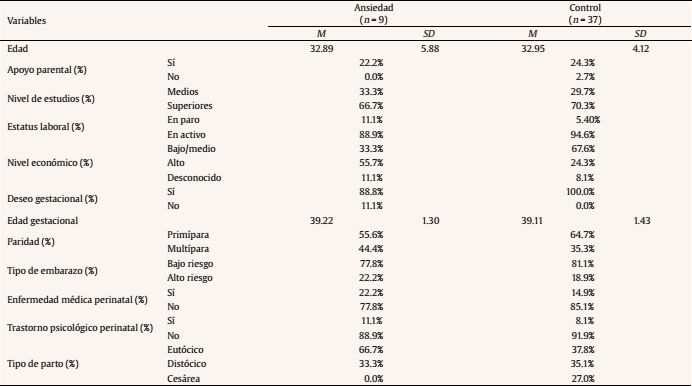 Tabla 4 Características infantiles por grupos 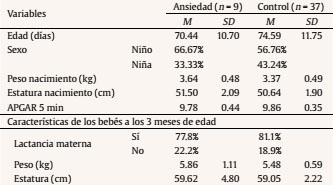 Análisis Preliminar Ansiedad materna prenatal y otros síntomas psicopatológicos. El grupo control y el de ansiedad materna prenatal fueron diferentes en cuanto psicopatología prenatal concomitante medida mediante el SCL-90-R. Respecto a los índices globales, hubo diferencias significativas entre el grupo ansiedad materna prenatal y control en el número de síntomas presentes, F(1, 44) = 16.19, p < .001, y el índice global de severidad, F(1, 44) = 15.10, p < .001. Según eta cuadrado un 25% del malestar psicológico global y un 27% de síntomas presentes se explicaron por la variabilidad en el nivel de ansiedad prenatal y no por las diferencias individuales. Respecto a las escalas clínicas, hubo diferencias estadísticamente significativas en cuanto a obsesión-compulsión, F(1, 44) = 15.98, p < .001, sensibilidad interpersonal, F(1, 44) = 23.27, p < .001, depresión, F(1, 44) = 7.69, p < .05, ansiedad, F(1, 44) = 14.60, p < .001, ansiedad fóbica, F(1, 44) = 9.12, p < .05, ideación paranoide, F(1, 44) = 7.97, p < .05, psicoticismo, F(1, 44) = 10.05, p < .05, y síntomas adicionales, F(1, 44) = 5.83, p < .05. Las escalas que mejor explicaban por la proporción de varianza atribuida a la ansiedad prenatal fueron sensibilidad interpersonal (35%), obsesión-compulsión (27%) y ansiedad (25%). Ansiedad materna y trastornos psicológicos posnatales. Mediante la entrevista MINI se evaluó a las gestantes con el objetivo de controlar los trastornos psicológicos de inicio en el postparto. Solo una gestante cumplió criterios para el TOC y fue eliminada. Las puntuaciones del BAI indicaron que los grupos no diferían en ansiedad materna posnatal (Z = -1,76 p=.079). Efecto estresor Still-Face. Los grupos no diferían respecto al efecto estresor. Así lo comprobamos en cada una de las fases del procedimiento según las variables respuesta evitación de la mirada (χ2 = 3.33, p = .068), (χ2 = 0.31, p = .579) y (χ2 = 0.14, p = .706), sonrisa (χ2 = 0.71, p = .398), (χ2 = 0.05, p = .823), (χ2 = 0.00, p = .959) y expresión negativa (χ2 =1.35, p = .246), (χ2 = 0.06, p = .802) y (χ2 = 0.74, p = .389). Ritmicidad circadiana de cortisol. Para comprobar que la ritmicidad circadiana del cortisol no influía en los resultados, se realizó una comparación intergrupos en las horas de recogida de las muestras de cortisol en saliva (mañana/tarde). Se comprobó que no hubo diferencias significativas (p = .307) respecto a la hora de determinación del cortisol. Desarrollo psicológico infantil. Los bebés de las madres del grupo control y ansiosas fueron clasificados a su vez según su puntuación en la BL-R. Los grupos estuvieron formados por bebés con un QD global igual o superior a la media de la escala (> 100 puntos) o inferior a la media (< 100 puntos). Se detallan las puntuaciones de la BL-R en la Tabla 5. Tabla 5 Resultados en desarrollo psicológico infantil 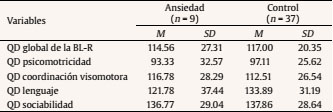 Análisis Principal Efectos principales. Considerados independientemente, no hay influencia de la ansiedad materna prenatal, F(1, 42) = .42, p = .519, el desarrollo psicológico infantil, F(1, 42) = 3.2, p = .079, y la reactividad del eje HPA, F(1, 42) = .70, p = .409, sobre el nivel de cortisol infantil. La variable desarrollo psicológico infantil presentó el valor de F más próximo a la significación estadística. Efectos de interacción. No hallamos efectos de la interacción entre la ansiedad materna prenatal y el desarrollo psicológico infantil sobre el nivel de cortisol infantil, F(1, 42) = 2.11, p = .154. De igual forma, no se comprobó estadísticamente el efecto de la interacción entre el desarrollo psicológico infantil y la reactividad del eje HPA, F(1, 42) = .47, p = .498. Por último, no encontramos los efectos de la interacción entre la ansiedad materna prenatal y la reactividad del eje HPA, F(1, 42) = .97, p = .330. Mediante análisis de la interacción de segundo orden en la que se basaba nuestra hipótesis experimental, concluimos que no hay relación entre las tres variables independientes analizadas, F(1, 42) = 1.39, p = .246. A pesar del resultado no significativo, es interesante analizar las tendencias que se observan en la representación gráfica respecto a la combinación de los tres factores (Figura 2). Figura 2 Representación gráfica de los efectos de interacción entre la reactividaddel eje HPA, la ansiedad materna prenatal y el desarrollo psicológico infantil.Las barras de error corresponden al error estándar. 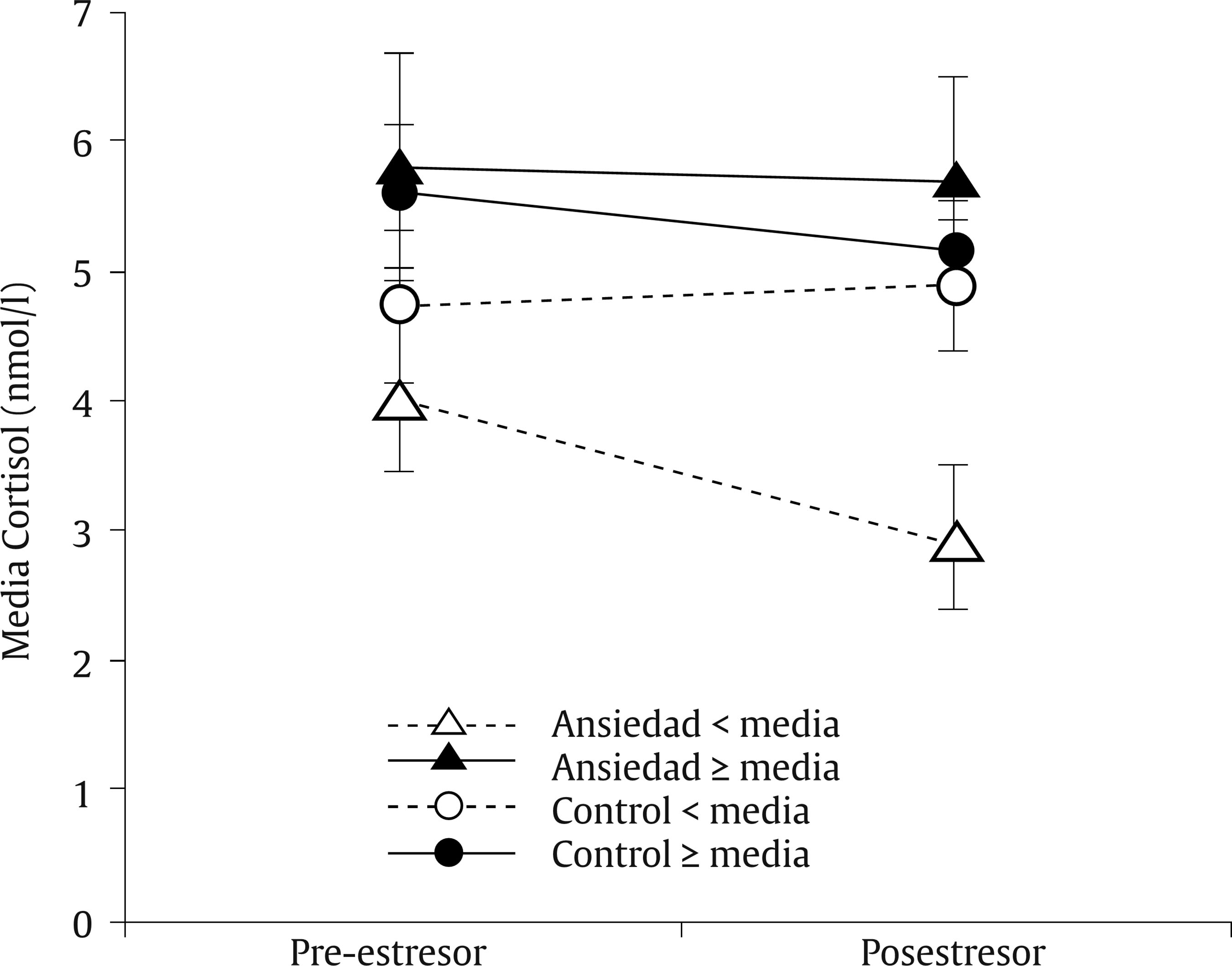 Los grupos control estuvieron más cercanos a la media general del grupo que los grupos ansiedad materna prenatal. El grupo que mayores medias de cortisol mostró tanto en la medida preestresor como posestresor fue el grupo ansiedad materna prenatal con desarrollo psicológico igual/superior a la media. Los niños que mostraron menores medias en la medidas preestresor y posestresor fueron el grupo ansiedad materna prenatal con desarrollo psicológico inferior a la media. En este grupo se observa un perfil de hiporreactividad del cortisol al ser la medida posestresor menor que la preestresor. En los grupos control observamos la tendencia contraria. Mientras que el grupo control con desarrollo psicológico igual/superior a la media muestra un perfil de hiporreactividad, el grupo control con desarrollo psicológico inferior a la media muestra un perfil de hiperreactividad. DiscusiónNuestro objetivo con la realización del presente estudio fue demostrar los efectos interactivos entre la ansiedad materna prenatal, el desarrollo psicológico y la reactividad del eje HPA, observando modificaciones en el nivel de cortisol infantil. En contra de nuestras expectativas, nuestros resultados no fueron significativos estadísticamente. En nuestra investigación ninguna de las variables independientes estudiadas ni su interacción se asoció a un efecto en el nivel de cortisol infantil en bebés de 2-3 meses. Estos resultados pueden explicarse por los siguientes hallazgos. En primer lugar, respecto al estrés materno durante el embarazo, probablemente una fuerte ansiedad materna podría haber modificado la respuesta de cortisol infantil. La ansiedad materna estudiada en nuestra investigación fue de intensidad subclínica. En otras investigaciones, que sí han hallado efectos en la reactividad del eje HPA midiendo cortisol infantil en función de la ansiedad prenatal, las intensidades utilizadas fueron clínicas. Por ejemplo, en la investigación de Brennan et al. (2008) y en la de Grant et al. (2009) se utilizan medidas clínicas de trastornos de ansiedad evaluados a través de la SCID según criterios DSM-IV. En otra investigación (Tollenaar et al., 2011), al igual que en la nuestra, estudiaron la ansiedad prenatal subclínica y tampoco obtuvieron diferencias. Además, en el análisis preliminar obtuvimos una clara falta de homogeneidad entre ambos grupos respecto a sintomatología psicológica medida mediante el SCL-90-R. De esta forma podemos dudar de que realmente los grupos fuesen diferentes únicamente en ansiedad materna prenatal o de que los grupos conformados mediante la puntuación de ansiedad generalizada que ofrece el STAI reflejen diferencias. En una revisión realizada por Brunton, Dryer, Saliba y Kohlhoff (2015) se diferenció la ansiedad específica relacionada con el embarazo de otros tipos de psicopatología ansiosa como los trastornos de ansiedad o la sintomatología ansiosa generalizada. Estos autores resaltan que, aunque la sintomatología ansiosa generalizada puede provocar resultados adversos durante el embarazo, es la ansiedad específica relacionada con el embarazo la que se asocia principalmente a resultados adversos en el desarrollo fetal e infantil y supone un factor de riesgo para la depresión posnatal. Por tanto, en función de nuestros resultados en el SLC-90-R, la ansiedad específica relacionada con el embarazo podría implicar una nueva categoría diagnóstica diferente al resto de trastornos de ansiedad. Respecto a la cantidad de medidas de cortisol utilizadas también hemos observado diferencias entre nuestra investigación y otros estudios. En nuestra investigación, por un criterio de eficiencia, tan sólo pudimos recoger una medida preestresor y una medida posestresor y esto pudo enmascarar un efecto de reactividad que podríamos haber hallado de haber tomando más medidas preestresor o posestresor para recoger correctamente la variabilidad interindividual en el pico de cortisol. En cuanto a la medida preestresor, o línea base, observamos en nuestros datos que es mayor que la medida posestresor. Esto pudo ser debido a que la llegada al hospital o el hecho de encontrarse en un contexto extraño pudo ser más estresante para el bebé que el procedimiento Still-Face. Para solucionar este aspecto lo ideal seria la obtención de la línea base en un contexto relajado y familiar para el bebé (como su casa). En cuanto a la medida posestresor, diferentes estudios han reportado que en bebés hay una considerable variación en el tiempo y magnitud del pico de la respuesta de cortisol posestresor (Grant et al., 2009; Ramsay y Lewis, 2003). Algunos investigadores han hallado diferencias en la reactividad del eje HPA infantil en función de la ansiedad materna prenatal recogiendo varias muestras posestresor (Brennan et al., 2008). No obstante, otros autores, al igual que nosotros, tampoco encontraron estas diferencias en la respuesta de cortisol, a pesar incluso de haber tomado varias medidas posestresor. Tal es el caso de la investigación del equipo de Tollenaar (Tollenaar et al., 2011) que midió la línea base del cortisol de los niños y después obtuvo dos medidas posestresor a los 25 y a los 40 minutos. Ellos tampoco encontraron diferencias en la reactividad del eje HPA después de utilizar como estresor el paradigma Still-Face cuando los niños contaban con 5 meses de edad. De hecho, la edad de los niños también ha podido influir en la variabilidad de las respuestas del glucocorticoide. En las investigaciones publicadas en relación a la ansiedad materna prenatal y la reactividad del eje HPA, la edad de los niños oscilaba entre los 5 y 7 meses. En nuestra investigación la media de edad fue de 2.5 meses ± 11.5 días. La edad de los bebés pudo ser un hándicap porque pudo no estar establecida la ritmicidad diurna del cortisol (De Weerth, Zijl y Buitelaar, 2003). Aún sabemos muy poco sobre la maduración psicobiológica del eje HPA. Algunos investigadores han comprobado que los bebés muestran un decremento de cortisol ante los estresores con la edad (Larson, White, Cochran, Donzella y Gunnar, 1998; Lewis y Ramsay, 1995). En una investigación de Larson et al., (1998) se comprobó que los bebés menores de 2 meses mostraban comportamientos de enfado (rabieta y llanto) y un aumento de cortisol después de un examen médico. No obstante, hacia los 3 meses se observan las disrupciones comportamentales durante el examen pero no hubo diferencia entre la medida de cortisol preestresor y posestresor (Larson et al., 1998). Por otra parte, Lewis y Ramsay (1995) reportaron una disminución de la respuesta de cortisol ante estresores físicos a partir de los 2 meses de edad y una mayor estabilidad de la respuesta entre los 4 y 6 meses. Nuestras mediciones de cortisol se recogieron en el momento crítico del cambio evolutivo en el desarrollo posnatal del eje HPA y por ello no hallamos diferencias en función del desarrollo psicológico. Puede que este hecho haya sesgado nuestros datos tanto en el grupo control como en el grupo experimental, puesto que comprobamos que ambos grupos fueran homogéneos en edad. Aparte de esto, la edad de los bebés también pudo disminuir el efecto estresor del paradigma Still-Face. Cuando se usan paradigmas que generan respuestas emocionales de frustración, como el Still-Face, algunos estudios no han conseguido demostrar diferencias significativas en los niveles de cortisol posestresor cuando los bebés son menores de 6 meses (Jansen, Beijers, Riksen-Walraven y De Weerth, 2010). Los bebés menores de 6 meses parecen estresarse más ante la estimulación física que ante una estimulación psicológica. Como indican Tollenaar et al. (2011), los estresores físicos generales (e.g., sesión de baño o vacunación) suscitan mayor reactividad de cortisol que los estresores psicológicos porque son más fácilmente reconocibles por los bebés. Además, se ha comprobado que los bebés de madres estresadas prenatalmente no interpretan adecuadamente las señales sociales en la interacción (Weinstock, 2015) y por ello el efecto que les producen los estresores psicológicos como la cara inexpresiva de la madre es menor. Sin embargo, en nuestros datos no hallamos diferencias intergrupales en el efecto Still-Face entre los grupos de ansiedad prenatal y de control, por lo que podemos asegurar que el efecto del estresor fue similar en ambos grupos. Aunque este paradigma estresase notablemente a los bebés, el apoyo emocional materno sería un factor social crítico que modera el impacto de los estímulos ambientales sobre el niño (Gunnar, Talge y Herrera, 2009). De hecho, los bebés presentan menor reactividad del eje HPA ante el paradigma Still-Face cuando reciben estimulación táctil materna que los niños que no reciben este tipo de estimulación durante el paradigma (Feldman, Singer y Zagoory, 2010). En nuestro procedimiento, las madres no tocaron ni atendieron a los niños durante la fase Still-Face pero sí permitimos la estimulación táctil en las fases de interacción normal. Por tanto, la respuesta psicofisiológica del eje HPA pudo verse amortiguada mediante esta estimulación materna. En consonancia con esta idea se ha comprobado que la estimulación táctil se asocia a menores niveles de catecolaminas y cortisol, lo que provoca estados de relajación en el bebé (Underdown, Barlow y Stewart-Brown, 2010). Estos resultados ponen de relieve la importancia de la figura de apego para el desarrollo de la regulación emocional infantil desde los primeros meses de vida. En efecto, los niños con apego seguro no muestran un aumento significativo en la respuesta de cortisol ante episodios emocionales de frustración (Roque, Veríssimo, Oliveira y Oliveira, 2012). Parece que los factores ambientales posnatales también pueden programar el neurodesarrollo y la respuesta del eje HPA (Gunnar y Quevedo, 2007). Es más, en la literatura científica se han diferenciado dos perfiles alterados en la reactividad del eje HPA en función de la intensidad del estímulo estresante posnatal: por una parte encontramos niños que han sufrido separación o rechazo parental de manera esporádica, caso en el que se observa un patrón de hiperreactividad, y, por otra parte, en los niños que han sufrido maltrato, negligencia o institucionalización como estrés crónico se observa un patrón de hiporreactividad (Gunnar, Brodersen, Nachmias, Buss y Rigatuso, 1996; Loman y Gunnar, 2010; Reguera, 2014). Igual que los estímulos posnatales pueden programar el eje HPA infantil produciendo diferentes perfiles de reactividad, la ansiedad prenatal podría producir diferentes perfiles de reactividad del eje HPA infantil (hiperreactividad o hiporreactividad) en relación con el desarrollo psicológico del niño. Es decir, la respuesta del eje HPA infantil sería proporcional a la ansiedad prenatal materna y a su vez esta relación se vería modulada por el desarrollo psicológico. Aunque nuestros resultados no resultaron significativos a nivel estadístico, sí pudimos comprobar cierta significación clínica. De esta forma, observamos un perfil de hiperreactividad del eje HPA en el grupo ansiedad materna prenatal con desarrollo psicológico igual/superior a la media. Este grupo presentó las cifras más altas tanto en la medida de cortisol preestresor como en la medida de cortisol posestresor. Es decir, este grupo sería muy sensible a los estresores, motivo por el cual sus niveles de cortisol podrían estar más elevados. Si nos apoyamos en la investigación animal (Maccari et al., 2003; Weinstock, 2008), podemos conjeturar que la explicación psicobiológica de este nivel de cortisol elevado se basaría en mecanismos epigenéticos. La ansiedad materna podría programar a nivel fetal la regulación de receptores de glucocorticoides (GR) y de mineralocorticoides (MR) en diferentes estructuras cerebrales. La programación debida a la ansiedad materna prenatal podría asociarse a un aumento de la metilación de receptores GR y MR, evitando su expresión génica en estructuras que ejercen un efecto inhibitorio en el eje HPA, como el hipocampo, la amígdala, el cortex prefrontal o el hipotálamo. Esto podría provocar un fallo en el sistema de retroalimentación negativa del eje HPA y, como resultado, el niño presentaría unos niveles de glucocorticoides aumentados tanto en su ritmicidad circadiana como en respuesta al estresor. Por otra parte, cuando se producen una elevación prolongada o repetida de glucocorticoides y se mantiene durante mucho tiempo este fallo en la retroalimentación negativa del eje HPA, podemos observar efectos opuestos (Loman y Gunnar, 2010). De esta forma, si la ansiedad materna prenatal es muy prolonganda podría programar el eje HPA fetal hacia un perfil de hiporreactividad. El fallo en la retroalimentación negativa del eje HPA antes descrito podría propiciar un aumento de CRH en el hipotálamo, lo cual podría generar una regulación a la baja de la producción de ACTH hipofisiaria y de la respuesta de otras estructuras cerebrales (como la amígdala, el cortex prefrontal o el hipocampo) por desensibilización de sus receptores. Es decir, se satura el sistema del eje HPA infantil y, como consecuencia, se produce una bajada del nivel de cortisol tanto en la ritmicidad circadiana como en respuesta al estresor. En la misma línea, se ha comprobado en ratas que la disfunción del eje HPA puede afectar al desarrollo y arquitectura del cortex prefrontal generando problemas en su asimetría funcional y déficits en las funciones ejecutivas (Sullivan y Gratton, 2002). Probablemente por estos motivos en nuestra investigación hemos observado gráficamente que el grupo con menor nivel de cortisol tanto en la medida preestresor como posestresor fue el grupo de ansiedad prenatal con desarrollo inferior a la medida. A pesar de que nuestros datos no fueron significativos a nivel estadístico, podemos intuir, a la vista de nuestros resultados en la representación gráfica, que la ansiedad prenatal podría asociarse a efectos diferenciales en la reactividad del eje HPA en función del desarrollo psicológico infantil y que estos efectos podrían explicarse por mecanismos epigenéticos mediante la intensidad y el tiempo de exposición a los glucocorticoides maternos. En caso de exposición a la ansiedad prenatal, el niño presentaría un nivel de cortisol elevado (hiperreactividad del eje HPA) si presentase un desarrollo psicológico por encima/igual de la media mientras que si presenta un desarrollo psicológico por debajo de la media su nivel de cortisol se asociaría a un perfil de hiporreactividad del eje HPA. En el caso de que las madres no presenten ansiedad prenatal, las diferencias en el nivel de cortisol entre los grupos serían menores y además el perfil de reactividad del eje HPA seguiría la tendencia contraria: hiperreactividad del eje HPA en los niños con desarrollo psicológico por debajo de la media e hiporreactividad del eje HPA en los niños con desarrollo psicológico por encima/igual de la media. Esto explicaría por qué en algunas investigaciones se obtienen correlaciones positivas entre la ansiedad prenatal, la reactividad del eje HPA (Brennan et al., 2008) y/o el desarrollo psicológico (DiPietro, 2011), en otras correlaciones negativas (Bergman et al., 2007; Tollenaar et al., 2011) y en otras no hay diferencias, como en nuestro estudio. Implicaciones Clínicas Desde un punto de vista clínico, creemos que es fundamental comenzar a investigar programas de intervención clínica en paralelo a las investigaciones sobre la evaluación y los efectos de la ansiedad materna prenatal. Creemos que mediante intervenciones psicológicas (desde cualquiera de sus modelos) se pueden prevenir o mitigar los efectos adversos prenatales y posnatales en aquellos casos en los que la ansiedad materna los produzca. Por ejemplo, un adecuado desarrollo del vínculo de apego es un potente amortiguador de los efectos de la ansiedad prenatal (Bergman, Sarkar, Glover y O’Connor, 2010). Algunos investigadores y clínicos (e.g., García-Dié y Placín, 1999) manifiestan la necesidad de una atención multidisciplinar en todo el proceso de “maternización”, de manera que la atención obstétrica, neonatológica y psicológica vayan unidas desde el embarazo hasta la crianza. Limitaciones Encontramos varias limitaciones metodológicas que han amenazado la validez de nuestro estudio. Primero, la principal limitación que ha afectado a nuestra investigación es el pequeño tamaño muestral del grupo ansiedad materna prenatal (9 díadas). Segundo, consideramos que una gran fuente de error en nuestra investigación proviene de la fiabilidad de las medidas, así como del contexto y de la forma de evaluación. Tal vez el STAI sea una medida inadecuada para observar con precisión la ansiedad prenatal. Compartimos la opinión de algunos autores sobre la necesidad de construir y validar instrumentos específicos para valorar la ansiedad/ansiedad prenatal (Brunton et al., 2015). Por otra parte, la fiabilidad de la medida de cortisol infantil también pudo verse alterada por cómo y dónde fue recogida. Respecto al cómo, el trabajo con bebés requiere cierta flexibilidad en los procedimientos porque, por cuestiones éticas y humanas, hay que anteponer las necesidades materno-infantiles a cualquier aspecto de la investigación. Por tanto, en algunos casos se tuvo que variar el orden de las pruebas de evaluación para adaptarnos a estas necesidades y evitar que otras variables contaminadoras, como la toma de alimento o el sueño, afectaran a la medida de cortisol. Respecto al dónde, puede que la línea base de cortisol ya reflejara una cierta reactividad del eje HPA, al ser la situación de evaluación en el hospital un entorno estresante para los bebés. Tercero, pudieron ocurrir acontecimientos psicológicos entre la medida de estrés durante la gestación y la medida de los bebés a los 2-3 meses que escaparon a nuestro control, como el vínculo de apego formado en las díadas madre-bebé o la sensibilidad maternal. Extended SummaryThe womb is the first developmental environment. Once developmental psychobiologists started to investigate intrauterine evolution of infants and its long-term impact, they found that both prenatal and postnatal development is influenced by the mother’s psychological health. Specifically, scientific research evidence indicates that prenatal stress is a possible cause of subsequent psychopathological vulnerability. This vulnerability comes from stress sensitivity and is the basis of many disorders in childhood. In the last decade, there has been evidence for a fetal origin of stress sensitivity in the context of the fetal programming theory (Entringer, Kumsta, Hellhammer, Wadhwa, & Wust , 2009; Grant, et al., 2009; Gutteling, de Weerth, & Buitelaar, 2005; O’Connor et al., 2005). According to the fetal programming hypothesis, babies who have been exposed to high levels of prenatal stress will develop increased HPA axis reactivity and thus increased stress sensitivity in the postnatal period. In the field of animal psychobiology, several studies have shown that prenatal stress could play some role in fetal programming of neurodevelopment and HPA axis (Weinstock, 2005, 2008). In human psychobiology, evidence is less clear. Although research in this regard has been growing during the last few years, additional studies are needed to investigate the relationship between maternal stress and fetal programming of neurodevelopment and the HPA axis in humans, to confirm findings which are evident from animal psychobiology. The main purpose of this study was to prospectively investigate the relationship between prenatal stress, psychological development, and HPA axis reactivity in 2- and 3-month-old infants. Method This research was designed under the structure of partially repeated measures, with three factors: two intergroup factors (prenatal anxiety and psychological development) and one intragroup factor (HPA axis reactivity). The dependent variable was blood cortisol concentration, estimated from the determination of salivary cortisol in infants. Preconcepcional, prenatal, perinatal, postnatal, and neonatal variables that would interfere with the results were also tested. This study was conducted at the Puerta de Hierro University Hospital, Majadahonda (Madrid). In the first phase, a total of 141 subjects with singleton pregnancy and gestational age range of 36-41 weeks were recruited. During a monitoring session women completed a battery of tests to assess their prenatal anxiety and other preconceptional and prenatal variables. Prenatal anxiety was measured using the State-Trait Anxiety Inventory (STAI) and the Pregnancy Anxiety Scale (PAS). Control of prenatal psychopathology was performed using the Symptom Checklist 90 Revised (SCL-90-R). An epidemiological questionnaire was created to assess preconcepcional and prenatal variables. Depending on the STAI score, pregnant women were assigned to the control group (percentile score less than 70 on the STAI scales) or prenatal anxiety group (percentile score greater than or equal to 70 on the STAI scales). Finally, in 46 out of the remaining 70 cases the mother-baby dyads was studied (Figure 1). This dyads were assessed when the child was 2 to 3.5 months old. Psychological development was tested using the Revised Brunet-Lézine (BL-R) scale. The babies of the control and anxious mothers were in turn classified based on their score on the BL-R. The groups consisted of babies with a QDglobal equal to or greater than the mean of the scale (> 100 points) or lower than the average (< 100 points). The HPA axis reactivity was assessed at two moments: baseline before the stressor and 20 minutes after the stressor, which was induced following the Still-Face paradigm. Control of anxiety and postnatal depression was achieved employing the International Neuropsychiatric Interview (MINI) and the Beck Anxiety Inventory (BAI). Other perinatal, postnatal and neonatal variables were controlled with an epidemiological questionnaire prepared by us. Results Preliminary analysis. The groups were homogeneous in all sociodemographic, obstetric, and perinatal variables. There was an exception in the pregnancy desire prenatal variable (χ2 = 10.05, p < .05). The control and prenatal maternal anxiety groups were different in terms of concomitant prenatal psychopathology measured by the SCL-90-R. Regarding the clinical scales, there were statistically significant differences in terms of obsession-compulsion, F(1, 44) = 15.98, p < .001, interpersonal sensitivity, F(1, 44) = 23.27, p < .001, depression, F(1, 44) = 7.69, p < .05, anxiety, F(1, 44) = 14.60, p < .001, phobic anxiety, F(1, 44) = 9.12, p < .05, paranoid ideation, F(1, 44) = 7.97, p < .05, psychoticism, F(1, 44) = 10.05, p < .05, and additional symptoms, F(1, 44) = 5.83, p < .05. The scales that were best explained by the proportion of variance attributed to prenatal anxiety were interpersonal sensitivity (35%), obsession-compulsion (27%), and anxiety (25%). Both groups were homogeneous regarding postnatal maternal anxiety, postnatal psychological disorders, Still-Face effect, and circadian rhythmicity of cortisol. Main analysis. Considered independently, there is no influence of prenatal maternal anxiety, F(1, 42) = 0.42, p = .519, infant psychological development, F(1, 42) = 3.2, p = .079, and the reactivity of the child HPA axis, F(1, 42) = .70, p = .409, on the level of infant cortisol. Neither effects of the interation between prenatal maternal anxiety and infant psychological development on infant cortisol level, F(1, 42) = 2.11, p = .154, between child psychological development and HPA axis reactivity, F(1, 42) =. 47, p = .498, nor effects of the interaction between child maternal anxiety and HPA axis reactivity, F(1,42) = .97, p = .330 were found. Through the analysis of second-order interaction on which our experimental hypothesis was based, we conclude that there is no relationship between the three independent variables analyzed, F(1, 42) = 1.39, p = .246. Despite the non-significant result, it is interesting to analyze the trends observed in the graphic representation regarding the combination of the three factors (Figure 2). The group with highest cortisol levels showed in both pre-stressor and post-stressor measures was the prenatal maternal anxiety group with psychological development equal to/above the mean. The children who showed lower means inpre-stressor and post-stressor measures were the prenatal maternal anxiety group with lower psychological development. In this group, a cortisol hyporesponsiveness profile is observed. In control groups we observe the opposite tendency. While the control group with psychological development equal to/above the mean shows a profile of hyporeactivity, the control group with lower psychological development shows a hyperreactivity profile. Discussion The aim of the present study was to demonstrate the interactive effects between prenatal maternal anxiety, psychological development, and HPA axis reactivity observing changes in infant cortisol in 2-3 month-old babies. Contrary to our expectations, the results were not statistically significant. These results can be explained by the following findings. First, regarding maternal stress during pregnancy, probably a stronger maternal anxiety could modify the response of infant cortisol as verified by other studies (e.g., Brennan et al., 2008). In addition, specific anxiety related to pregnancy is mainly associated with adverse outcomes in fetal and infant development (Brunton, Dryer, Saliba, & Kohlhoff, 2015). Interestingly, the groups in our research were different in psychological symptomology and, therefore, the specific anxiety related to pregnancy could imply a new diagnostic category different from the rest of anxiety disorders. Secondly, we were only able to collect a pre-stressor and post-stressor measure and this could mask a reactivity effect. Different studies have reported considerable variation in the time and magnitude of post-stress cortisol peaks in infants (Grant et al., 2009; Ramsay & Lewis, 2003). The age of the children could have also influenced the variability of glucocorticoid responses. The diurnal rhythmicity of cortisol may not have been established (De Weerth, Zijl, & Buitelaar, 2003). Regarding the response before stressful stimuli, some researchers found that babies show a decrease in cortisol from stressors with the age of 2-3 months (Larson, White, Cochran, Donzella, & Gunnar, 1998; Lewis & Ramsay, 1995). In addition, the age of the babies could also reduce the stressful effect of the Still-Face paradigm. Babies under 6 months of age seem to be stressed more by physical stimulation than by psychological stimulation (Jansen, Beijers, Riksen-Walraven, & De Weerth, 2010). However, although this paradigm stresses babies significantly, emotional support from mothers would be a critical social factor that moderates the impact of environmental stimuli on the child (Gunnar, Talge, & Herrera, 2009) through, for example, the tactile stimulation (Feldman, Singer, & Zagoory, 2010) and the establishment of a safe attachment (Roque, Veríssimo, Oliveira, & Oliveira, 2012). Postnatal environmental factors can also program neurodevelopment and HPA axis response (Gunnar & Quevedo, 2007), generating patterns of hyperreactivity to sporadic separations or parental rejection or hyporeactivity to chronic stress generated by abuse, neglect, or institutionalization (Gunnar, Brodersen, Nachmias, Buss, & Rigatuso, 1996; Loman & Gunnar, 2010; Reguera, 2014). In the same way that postnatal stimuli can program infant HPA axis producing different profiles of reactivity, prenatal anxiety could produce different profiles of reactivity of the infant HPA axis (hyperreactivity or hyporeactivity) in relation to the psychological development of the child. That is, the response of infant HPA axis would be dose-dependent on maternal prenatal anxiety and this relationship could be modulated by psychological development. These effects could be explained by epigenetic mechanisms through the intensity and time of exposure to maternal glucocorticoids. Maternal anxiety would program fetal regulation of glucocorticoid (GR) and mineralocorticoid (MR) receptors in different brain structures. This would cause failure in the negative feedback system of the HPA axis and, as a result, the child would have increased glucocorticoid levels both in their circadian rhythmicity and in response to the stressor. On the other hand, when prolonged or repeated increases of glucocorticoids occur and the negative feedback of the HPA axis is kept for a long time (chronic stress), we can observe opposite effects (Loman & Gunnar, 2010). Along these lines, if prenatal maternal anxiety is very prolonged, a fetal HPA axis with a hyporeactivity profile could be programed. The failure in the negative feedback of the HPA axis described above would lead to an increase in CRH in the hypothalamus, which can generate a down regulation of the production of ACTH and the response of other brain structures (such as amygdala, prefrontal cortex, or hippocampus) desensitize its receptors. The infant HPA axis becomes saturated and as a consequence cortisol levels decrease in both the circadian rhythmicity and in response to the stressor. Para citar este artículo: Prieto, F., Portellano, J. A. y Martínez-Orgado, J. A. (2019). Ansiedad materna prenatal, desarrollo psicológico infantil y reactividad del eje HPA en bebés de 2 a 3 meses de edad. Clínica y Salud, 30, 23-33. https://doi.org/10.5093/clysa2019a5 Referencias |
Para citar este artículo: Prieto, F., Portellano, J. A. y Martínez-Orgado, J. A. (2019). Ansiedad materna prenatal, desarrollo psicológico infantil y reactividad del eje HPA en bebés de 2 a 3 meses de edad. Clínica y Salud, 30, 21-31. https://doi.org/10.5093/clysa2019a5
Correspondencia: fatima.prieto@unir.net (F. Prieto).
Copyright © 2026. Colegio Oficial de la Psicología de Madrid








 e-PUB
e-PUB CrossRef
CrossRef JATS
JATS







